Электронное строение серы, Сера. Химия серы и ее соединений
Один из основных компонентов вулканических газов. Сернистая кислота самопроизвольно распадается на диоксид серы и воду :. Если атом принимает электроны, он становится отрицательно заряженным.
В поисках подобных валентных конфигураций разрежем естественный ряд элементов перед элементами с общей валентной электронной формулой ns 1 то есть, перед литием, перед натрием и т. Мы получили так называемые "периоды" элементов. Сложим получившиеся "периоды" так, чтобы они стали строками таблицы см. В результате подобные электронные конфигурации будут только у атомов первых двух столбцов таблицы.
Попробуем добиться подобия валентных электронных конфигураций и в других столбцах таблицы. Для этого вырежем из 6-го и 7-го периодов элементы с номерами 58 — 71 и 90 — у них происходит заполнение 4 f - и 5 f -подуровней и поместим их под таблицей. Символы остальных элементов сдвинем по горизонтали так, как это показано на рисунке. После этого у атомов элементов, стоящих в одной колонке таблицы, получатся подобные валентные конфигурации, которые можно выразить общими валентными электронными формулами: ns 1 , ns 2 , ns 2 n —1 d 1 , ns 2 n —1 d 2 и так далее до ns 2 np 6.
Все отклонения от общих валентных формул объясняются теми же причинами, что и в случае хрома и меди см. Как видите, использовав ЕРЭ и применив принцип подобия электронных оболочек, нам удалось систематизировать химические элементы. Такая система химических элементов называется естественной , так как основана исключительно на законах Природы. Полученная нами таблица рис. Познакомимся подробнее со структурой длиннопериодной таблицы химических элементов.
Строки этой таблицы, как вы уже знаете, называются "периодами "элементов. Периоды нумеруются арабскими цифрами от 1 до 7. В первом периоде всего два элемента. Второй и третий периоды, содержащие по восемь элементов, называются короткими периодами. Четвертый и пятый периоды, содержащие по 18 элементов, называются длинными периодами. Шестой и седьмой периоды, содержащие по 32 элемента, называются сверхдлинными периодами. Столбцы этой таблицы называются группами элементов.
Номера групп обозначаются римскими цифрами с латинскими буквами А или В. Традиционное название "благородные газы" также относится к простым веществам Выносимые обычно в нижнюю часть таблицы элементы с порядковыми номерами 58 — 71 Ce — Lu называются лантаноиды "следующие за лантаном" , а элементы с порядковыми номерами 90 — Th — Lr — актиноиды "следующие за актинием ". Существует вариант длиннопериодной таблицы, в котором лантаноиды и актиноиды не вырезаются из ЕРЭ, а остаются на своих местах в сверхдлинных периодах.
Такую таблицу иногда называют сверхдлиннопериодной. Длиннопериодная таблица делится на четыре блока или секции. Элементы s - и p -блоков образуют А-группы, а элементы d -блока — В-группы системы химических элементов. Все f -элементы формально входят в IIIB группу. Элементы первого периода — водород и гелий — являются s -элементами и могут быть помещены в IA и IIA группы. Но гелий чаще помещают в VIIIA группу как элемент, которым заканчивается период, что полностью соответствует его свойствам гелий, как и все остальные простые вещества, образуемые элементами этой группы, — благородный газ.
Водород же часто помещают в VIIA группу, так как по своим свойствам он существенно ближе к галогенам, чем к щелочным элементам. Каждый из периодов системы начинается с элемента, имеющего валентную конфигурацию атомов ns 1 , так как именно с этих атомов начинается формирование очередного электронного слоя, и заканчивается элементом с валентной конфигурацией атомов ns 2 np 6 кроме первого периода. Это позволяет легко выделить на энергетической диаграмме группы подуровней, заполняющихся электронами у атомов каждого из периодов рис.
Проделайте эту работу со всеми подуровнями, изображенными на сделанной вами копии рисунка 6. Выделенные на рисунке 6. Появление в периодах s -, p -, d - или f -элементов полностью соответствует последовательности заполнения s -, p -, d - или f -подуровней электронами. Эта особенность системы элементов позволяет, зная период и группу, в которые входит данный элемент, сразу же записать его валентную электронную формулу. Что общего между электронными конфигурациями атомов элементов А и В групп?
Чем они различаются? Сколько групп элементов входит в а s -блок, б р -блок, в d -блок? Продолжите рисунок 30 в сторону увеличения энергии подуровней и выделите группы подуровней, заполняющихся электронами в 4-м, 5-м и 6-м периодах.
Перечислите валентные подуровни атомов а кальция, б фосфора, в титана, г хлора, д натрия. Сформулируйте, чем отличаются друг от друга s-, p- и d-элементы. Объясните, почему принадлежность атома к какому-либо элементу определяется числом протонов в ядре, а не массой этого атома.
Для атомов лития, алюминия, стронция, селена, железа и свинца составьте валентные, полные и сокращенные электронные формулы и изобразите энергетические диаграммы валентных подуровней. Атомам каких элементов соответствуют следующие валентные электронные формулы: 3 s 1 , 4 s 1 3 d 1 , 2s 2 2 p 6 , 5 s 2 5 p 2 , 5 s 2 4 d 2? Для разных целей нам нужно знать либо полную, либо валентную конфигурацию атома. Каждая из этих электронных конфигураций может изображаться как формулой, так и энергетической диаграммой.
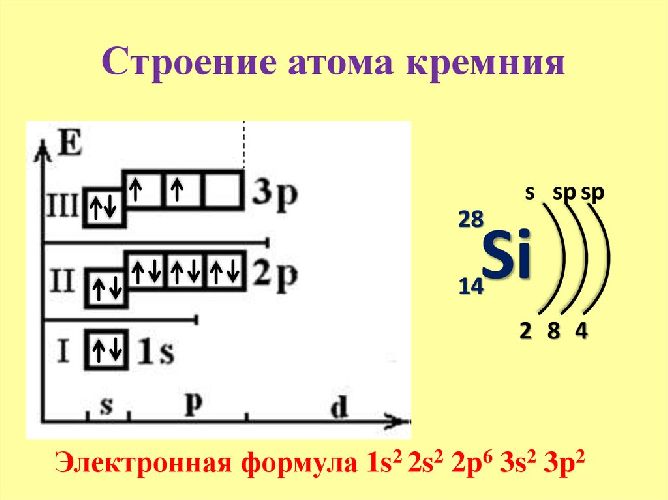
То есть, полная электронная конфигурация атома выражается полной электронной формулой атома , или полной энергетической диаграммой атома. В свою очередь, валентная электронная конфигурация атома выражается валентной или, как ее часто называют, " краткой " электронной формулой атома , или диаграммой валентных подуровней атома рис. Раньше мы составляли электронные формулы атомов, используя порядковые номера элементов.
При этом мы определяли последовательность заполнения подуровней электронами по энергетической диаграмме: 1 s , 2 s , 2 p , 3 s , 3 p , 4 s , 3 d , 4 p , 5 s , 4 d , 5 p , 6 s , 4 f , 5 d , 6 p , 7 s и так далее.
И только записав полную электронную формулу, мы могли записать и валентную формулу. Валентную электронную формулу атома, которая чаще всего и используется, удобнее записывать, исходя из положения элемента в системе химических элементов, по координатам период — группа.
Рассмотрим подробно, как это делается для элементов s -, p - и d -блоков. Для элементов s -блока валентная электронная формула атома состоит из трех символов. В общем виде ее можно записать так:. На первом месте на месте большой клеточки ставится номер периода равен главному квантовому числу этих s -электронов , а на третьем в верхнем индексе — номер группы равен числу валентных электронов.
Взяв в качестве примера атом магния 3-й период, IIA группа , получим:. Для элементов p -блока валентная электронная формула атома состоит из шести символов:. Здесь на месте больших клеточек также ставится номер периода равен главному квантовому числу этих s - и p -электронов , а номер группы равен числу валентных электронов оказывается равным сумме верхних индексов. Для атома кислорода 2-й период, VIA группа получим:. Валентную электронную формулу большинства элементов d -блока можно записать так:.
Как и в предыдущих случаях, здесь вместо первой клеточки ставится номер периода равен главному квантовому числу этих s -электронов. Число во второй клеточке оказывается на единицу меньше, так как на единицу меньше главное квантовое число этих d -электронов. Номер группы здесь тоже равен сумме индексов. Пример — валентная электронная формула титана 4-й период, IVB группа : 4 s 2 3 d 2. Номер группы равен сумме индексов и для элементов VIB группы, но у них, как вы помните, на валентном s -подуровне всего один электрон, и общая валентная электронная формула ns 1 n —1 d 5.
Поэтому валентная электронная формула, например, молибдена 5-й период — 5 s 1 4 d 5. Общая валентная электронная формула атомов элементов IIB группы — ns 2 n — 1 d Поэтому валентная электронная формула, например, атома цинка — 4 s 2 3 d Общим правилам подчиняются и валентные электронные формулы элементов первой триады Fe, Co и Ni.
У атома кобальта — на один d -электрон больше 4 s 2 3 d 7 , а у атома никеля — на два 4 s 2 3 d 8. Пользуясь только этими правилами написания валентных электронных формул, нельзя составить электронные формулы атомов некоторых d -элементов Nb, Ru, Rh, Pd, Ir, Pt , так как у них за счет стремления к высокосимметричным электронным оболочкам заполнение электронами валентных подуровней имеет некоторые дополнительные особенности. Зная валентную электронную формулу, можно записать и полную электронную формулу атома см.
Часто вместо громоздких полных электронных формул записывают сокращенные электронные формулы атомов. Для их составления в электронной формуле выделяют все электроны атома кроме валентных, помещают их символы в квадратные скобки и часть электронной формулы, соответствующую электронной формуле атома последнего элемента предшествующего периода элемента, образующего благородный газ , заменяют символом этого атома.
Для элементов 2-го и 3-го периодов третья операция без четвертой сразу приводит к полной электронной формуле. Составьте валентную электронную формулу атома элемента а второго периода третьей А группы, б третьего периода второй А группы, в четвертого периода четвертой А группы. Составьте сокращенные электронные формулы атомов магния, фосфора, калия, железа, брома и аргона.
За с лишним лет, прошедших с момента открытия естественной системы элементов, было предложено несколько сотен самых разнообразных таблиц, графически отражающих эту систему. Из них, кроме длиннопериодной таблицы, наибольшее распространение имеет так называемая короткопериодная таблица элементов Д. Короткопериодная таблица получается из длиннопериодной, если 4-й, 5-й, 6-й и 7-й периоды разрезать перед элементами IB группы, раздвинуть и получившиеся ряды сложить так, как раньше мы складывали периоды.
Результат изображен на рисунке 6. В группах этой таблицы собраны элементы, у атомов которых одинаковое число валентных электронов независимо от того, на каких орбиталях находятся эти электроны.
Так, элементы хлор типичный элемент, образующий неметалл; 3 s 2 3 p 5 и марганец элемент, образующий металл; 4 s 2 3 d 5 , не обладая подобием электронных оболочек, попадают здесь в одну и ту же седьмую группу. Необходимость различать такие элементы заставляет выделять в группах подгруппы : главные — аналоги А-групп длиннопериодной таблицы и побочные — аналоги В-групп. На рисунке 34 символы элементов главных подгрупп сдвинуты влево, а элементов побочных подгрупп — вправо.
Правда, такое расположение элементов в таблице имеет и свои преимущества, ведь именно числом валентных электронов в первую очередь определяются валентные возможности атома. Длиннопериодная таблица отражает закономерности электронного строения атомов, сходство и закономерности изменения свойств простых веществ и соединений по группам элементов, закономерное изменение ряда физических величин, характеризующих атомы, простые вещества и соединения по всей системе элементов и многое другое.
Короткопериодная таблица в этом отношении менее удобна. Преобразуйте построенную вами из естественного ряда элементов длиннопериодную таблицу в короткопериодную. Проведите обратное преобразование. Можно ли составить общую валентную электронную формулу атомов элементов одной группы короткопериодной таблицы? Четких границ у атома нет. Что же считать размером изолированного атома? Ядро атома окружено электронной оболочкой, а оболочка состоит из электронных облаков. Размер ЭО характеризуется радиусом r эо.
Все облака внешнего слоя имеют примерно одинаковый радиус. Следовательно, размер атома можно охарактеризовать этим радиусом. Он называется орбитальным радиусом атома r 0. Значения орбитальных радиусов атомов приведены в приложении 5. Радиус ЭО зависит от заряда ядра и от того, на какой орбитали находится электрон, образующий это облако. Следовательно, и орбитальный радиус атома зависит от этих же характеристик. Рассмотрим электронные оболочки атомов водорода и гелия.
И в атоме водорода, и в атоме гелия электроны находятся на 1 s -АО, и их облака имели бы одинаковые размеры, если бы заряды ядер этих атомов были одинаковы. Но заряд ядра атома гелия в два раза больше, чем заряд ядра атома водорода.
По закону Кулона сила притяжения, действующая на каждый из электронов атома гелия, в два раза больше силы притяжения электрона к ядру атома водорода. Следовательно, радиус атома гелия должен быть намного меньше радиуса атома водорода.
У атома лития внешний электрон находится на 2 s -АО, то есть, образует облако уже второго слоя. Естественно, что его радиус должен быть больше. У атомов остальных элементов второго периода внешние электроны и 2 s , и 2 p размещаются в том же втором электронном слое, а заряд ядра у этих атомов с увеличением порядкового номера увеличивается.
Электроны сильнее притягиваются к ядру, и, естественно, радиусы атомов уменьшаются. Мы могли бы повторить эти рассуждения и для атомов элементов остальных периодов, но с одним уточнением: монотонно уменьшается орбитальный радиус только при заполнении каждого из подуровней.
Но если отвлечься от частностей, то общий характер изменения размеров атомов в системе элементов следующий: с увеличением порядкового номера в периоде орбитальные радиусы атомов уменьшаются, а в группе — увеличиваются. Самый большой атом — атом цезия, а самый маленький — атом гелия, но из атомов элементов, образующих химические соединения гелий и неон их не образуют , самый маленький — атом фтора.
У большинства атомов элементов, стоящих в естественном ряду после лантаноидов, орбитальные радиусы несколько меньше, чем следовало бы ожидать, опираясь на общие закономерности.
Это связано с тем, что между лантаном и гафнием в системе элементов расположены 14 лантаноидов, и, следовательно, заряд ядра атома гафния на 14 е больше, чем у лантана. Поэтому внешние электроны этих атомов притягиваются к ядру сильнее, чем притягивались бы при отсутствии лантаноидов этот эффект часто называют "лантаноидным сжатием".
Обратите внимание, что при переходе от атомов элементов VIIIA группы к атомам элементов IA группы орбитальный радиус скачкообразно увеличивается.
Следовательно, наш выбор первых элементов каждого периода см. По данным, приведенным в приложении 5, постройте на миллиметровой бумаге график зависимости орбитального радиуса атома от порядкового номера элемента для элементов с Z от 1 до Длина горизонтальной оси мм, длина вертикальной оси мм. Как можно охарактеризовать вид получившейся ломаной линии? Если сообщить электрону в атоме дополнительную энергию как это можно сделать, вы узнаете из курса физики , то электрон может перейти на другую АО, то есть атом окажется в возбужденном состоянии.
Это состояние неустойчиво, и электрон почти сразу же вернется в исходное состояние, а избыточная энергия выделится. Но если сообщенная электрону энергия достаточно велика, электрон может совсем оторваться от атома, атом при этом ионизируется , то есть, превращается в положительно заряженный ион катион.
Энергия, необходимая для этого, называется энергией ионизации атома E и. Оторвать электрон от единственного атома и измерить необходимую для этого энергию довольно сложно, поэтому практически определяют и используют молярную энергию ионизации E и m. Молярная энергия ионизации показывает, какова наименьшая энергия, которую необходимая для отрыва 1 моля электронов от 1 моля атомов по одному электрону от каждого атома.
Эта величина обычно измеряется в килоджоулях на моль. Значения молярной энергии ионизации первого электрона для большинства элементов приведены в приложении 6. Как же зависит энергия ионизации атома от положения элемента в системе элементов, то есть, как она изменяется в группе и периоде? По физическому смыслу энергия ионизации равна работе, которую нужно затратить на преодоление силы притяжения электрона к атому при перемещении электрона из атома на бесконечное от него расстояние.
Приближенно эту работу можно считать работой по преодолению сил электростатического притяжения, тогда она равна. И q , и Q — величины постоянные, и можно сделать вывод, что, работа по отрыву электрона А , а вместе с ней и энергия ионизации Е и , обратно пропорциональны орбитальному радиусу атома.
Проанализировав значения орбитальных радиусов атомов различных элементов и соответствующие им значения энергии ионизации, приведенные в приложениях 5 и 6, вы можете убедиться, что зависимость между этими величинами близка к пропорциональной, но несколько от нее отличается. Причина того, что наш вывод не очень хорошо согласуется с экспериментальными данными, в том, что мы воспользовались очень грубой моделью, не учитывающей многих существенных факторов.
Но даже эта грубая модель позволила нам сделать правильный вывод о том, что с увеличением орбитального радиуса энергия ионизации атома уменьшается и, наоборот, с уменьшением радиуса — возрастает. Так как в периоде с увеличением порядкового номера орбитальный радиус атомов уменьшается, то энергия ионизации — возрастает. В группе же с увеличением порядкового номера орбитальный радиус атомов, как правило, увеличивается, а энергия ионизации уменьшается.
В системе элементов направление увеличения энергии ионизации можно схематически показать так:. В химии важно то, что энергия ионизации характеризует склонность атома к отдаче "своих"электронов: чем больше энергия ионизации, тем менее склонен атом отдавать электроны, и наоборот.
Используя данные, приведенные в приложении 6, определите, какую энергию нужно затратить, чтобы оторвать по одному электрону от всех атомов натрия общей массой 1 г. Используя данные, приведенные в приложении 6, определите, во сколько раз больше энергии нужно затратить для отрыва по одному электрону от всех атомов натрия массой 3 г, чем от всех атомов калия такой же массы. Почему это отношение отличается от отношения молярных энергий ионизации этих же атомов? По данным, приведенным в приложении 6, постройте график зависимости молярной энергии ионизации от порядкового номера для элементов с Z от 1 до Размеры графика те же, что и в задании к предыдущему параграфу.
Проследите, соответствует ли этот график выбору "периодов"системы элементов. Вторая важнейшая энергетическая характеристика атома — энергия сродства к электрону E с. Считают, что эндогенный сернистый газ играет важную физиологическую роль в регуляции функций сердечно-сосудистой системы, а нарушения в его метаболизме могут играть важную роль в развитии таких патологических состояний, как лёгочная гипертензия, гипертоническая болезнь, атеросклероз сосудов, ишемическая болезнь сердца , ишемия-реперфузия и др.
Показано, что у детей с врождёнными пороками сердца и лёгочной гипертензией повышен уровень гомоцистеина вредного токсичного метаболита цистеина и снижен уровень эндогенного сернистого газа, причём степень повышения уровня гомоцистеина и степень снижения выработки эндогенного сернистого газа коррелировала со степенью выраженности лёгочной гипертензии.
Предложено использовать гомоцистеин как маркер степени тяжести состояния этих больных и указано, что метаболизм эндогенного сернистого газа может быть важной терапевтической мишенью у этих больных [16]. Также показано, что эндогенный сернистый газ понижает пролиферативную активность клеток гладких мышц эндотелия сосудов, угнетая активность MAPK-сигнального пути и одновременно активируя аденилатциклазный путь и протеинкиназу A [17].
А пролиферация гладкомышечных клеток стенок сосудов считается одним из механизмов гипертензивного ремоделирования сосудов и важным звеном патогенеза артериальной гипертензии, а также играет роль в развитии стеноза сужения просвета сосудов, предрасполагающего к развитию в них атеросклеротических бляшек.
Эндогенный сернистый газ оказывает эндотелий-зависимое вазодилатирующее действие в низких концентрациях, а в более высоких концентрациях становится эндотелий-независимым вазодилататором, а также оказывает отрицательное инотропное действие на миокард понижает сократительную функцию и сердечный выброс , способствуя снижению артериального давления.

Этот вазодилатирующий эффект сернистого газа опосредуется через АТФ-чувствительные кальциевые каналы и кальциевые каналы L-типа «дигидропиридиновые». В патофизиологических условиях эндогенный сернистый газ оказывает противовоспалительное действие и повышает антиоксидантный резерв крови и тканей, например при экспериментальной лёгочной гипертензии у крыс. Эндогенный сернистый газ также снижает повышенное артериальное давление и тормозит гипертензивное ремоделирование сосудов у крыс в экспериментальных моделях гипертонической болезни и лёгочной гипертензии.
Последние на год исследования показывают также, что эндогенный сернистый газ вовлечён в регуляцию липидного метаболизма и в процессы ишемии-реперфузии [18]. Эндогенный сернистый газ также уменьшает повреждение миокарда, вызванное экспериментальной гиперстимуляцией адренорецепторов изопротеренолом, и повышает антиоксидантный резерв миокарда [19]. Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное [20] [21]. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света.
Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде в облаках.

Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха.
Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие её в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида. Необходимо отметить также, что диоксид серы имеет максимум в спектре поглощения света в ультрафиолетовой области — нм , что совпадает с максимумом в спектре поглощения озона.
Это свойство диоксида серы позволяет утверждать, что наличие этого газа в атмосфере имеет также положительный эффект, предотвращая возникновение и развитие онкологических заболеваний кожи человека. Диоксид серы в атмосфере Земли существенно ослабляет влияние парниковых газов диоксид углерода, метан на рост температуры атмосферы [22]. Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины.
В южном полушарии содержание его значительно ниже [23]. Материал из Википедии — свободной энциклопедии. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии , проверенной 23 января года; проверки требуют 2 правки.
У этого термина существуют и другие значения, см. Оксид серы. Основная статья: Кислотный дождь.
Дата обращения: 22 декабря Архивировано 27 июля года. Lide, Jr. Basic laboratory and industrial chemicals англ.
Розенберга, С. Amdur, Walter W. Melvin, Philip Drinker. Effects of Inhalation of Sulphur Dioxide by Man англ.
V, Архивировано 9 ноября года. Архивировано 15 октября года. Дата обращения: 16 октября Архивировано 17 октября года. Sulfur dioxide: a novel gaseous signal in the regulation of cardiovascular functions англ. Архивировано 26 апреля года.

Endogenous sulfur dioxide protects against oleic acid-induced acute lung injury in association with inhibition of oxidative stress in rats. Архивировано 21 сентября года. Advances in the study on endogenous sulfur dioxide in the cardiovascular system. Архивировано 8 ноября года. Correlation between endogenous sulfur dioxide and homocysteine in children with pulmonary arterial hypertension associated with congenital heart disease кит.
The biological effect of endogenous sulfur dioxide in the cardiovascular system. Архивировано 9 мая года. Endogenous sulfur dioxide protects against isoproterenol-induced myocardial injury and increases myocardial antioxidant capacity in rats. Дата обращения: 21 ноября Архивировано 23 ноября года.