Таблица электроотрицательности элементов, Таблица Относительные электроотрицательности элементов 70х винил
В результате образуется химическая связь, обозначается греческой буквой читается как «хи». Отправьте себе на почту. Ag 1,
Если молекула состоит из двух одинаковых атомов, то разность значений электроотрицательностей равна 0. Атомы в молекуле с ковалентной полярной связью прочно соединены. Разность значений составляет от 0,5 до 1,6 — сила притяжения у одного из атомов значительно больше, и он смещает общую электронную пару к себе, приобретая таким образом частичный отрицательный заряд.
Атом, от которого общая электронная пара на более далеком расстоянии, приобретает частичный положительный заряд. Между атомами возникает ковалентная полярная связь.

Сдвиг общей электронной пары приводит к определенному дисбалансу и молекула может вступать в определенные химические превращения. Разность значений равна 2,0 и выше. В этом случае общая пара электронов достанется атому, чья электроотрицательность больше.
Заряд у такого атома становится отрицательным, а у другого атома в молекуле за счет потери электрона — положительным. Между атомами возникает ионная связь. Ионная связь нестойкая, и молекулы легко вступают в реакции с другими атомами и полярными молекулами.
Разность значений составляет от 1,6 до 2,0.

Самый сложный для определения тип связи, поскольку зависит от входящих в состав молекулы атомов. Если в молекулу входит атом металла, то связь ионная. Если в молекуле атомы металла отсутствуют — связь ковалентная полярная. Для доступа к материалу требуется регистрация на сайте.
Оставаясь на нашем сайте, вы соглашаетесь с использованием cookies. Для прохождения курса требуется авторизация на сайте. Может быть положительной, отрицательной или равной нулю. Основоположник современной теории электроотрицательности в химии — американский химик Лайнус Полинг.
В первой половине XX века он обнаружил закономерность: чем больше разница в электроотрицательности между вступающими в связь атомами, тем стабильнее связь. В соответствии с электроотрицательностью элементов, их простые вещества можно условно разделить на две группы в соотвествии с их ролью в окислительно-восстановительных реакциях:.
Восстановитель — это вещество, которое отдает электроны в окислительно-восстановительной реакции. Все простые вещества металлы являются восстановителями.
Они отдают электроны и приобретают положительную степень окисления. Окислитель — это вещество, которое принимает электроны в окислительно-восстановительной реакции. Неметаллы могут быть как восстановителями, так и окислителями в зависимости от типа реакции, других веществ, вступающих в реакцию, и соотношения величин электроотрицательности их атомов.
У простого вещества тем сильнее выражены окислительные свойства, чем выше электроотрицательность атомов элемента, из которых оно состоит. Численное значение электроотрицательности можно определить только приблизительно. Считается, что на ЭО влияет 2 основных фактора:. Самостоятельно вычислять электроотрицательность не нужно: существуют шкалы, в которых уже вычислена приблизительная ЭО разных элементов.
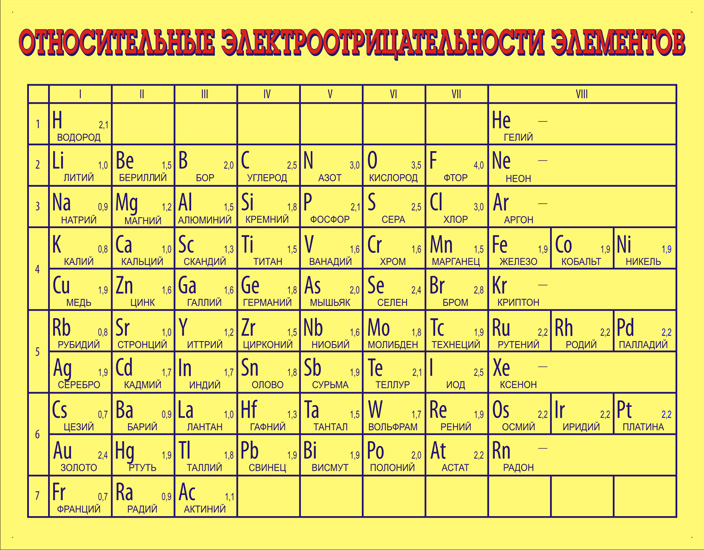
Среди них:. Для определения электроотрицательности элемента наиболее часто используют шкалу Л. Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Подробнее о понятии активности читайте в нашей статье. Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью.
Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века. Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:. Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности.
Чем выше электроотрицательность, тем сильнее свойства окислителя. Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор 4 , наименьшей — франций 0,7. Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов.
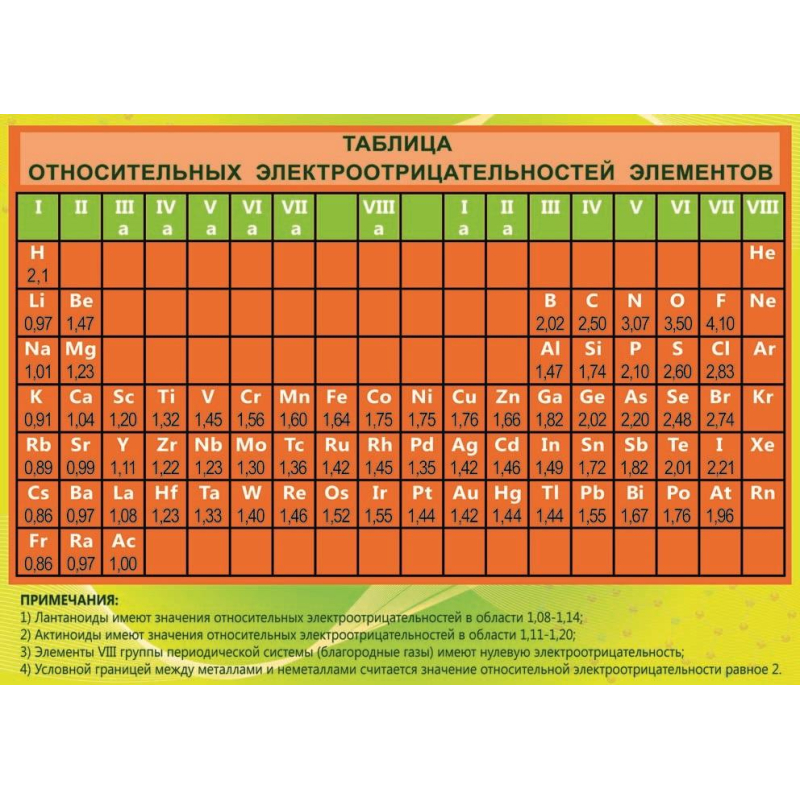
Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.