Бурные реакции в химии, 7 интересных химических опытов для детей
Также интересно наблюдать реакцию алюминия с иодом. Для этого нам нужно приготовить смесь поташа карбонат калия К 2 CO 3 раствором аммиака нашатырный спирт. Окуните ложку на несколько секунд в раствор нитрата ртути Hg NO 3 2.
Для этого добавляем в раствор перекиси водорода пенящееся средство для мытья посуды. Смешно Интересно. Мотоциклы Легковые Грузовые Автобусы Специальная техника. Сделай сам. Скорость Экстремальный спорт Боевые искусства Другое. Правовая информация. Правила сообщества. Полученный насыщенный раствор перелейте в другой стакан и по каплям добавляйте к этому раствору концентрированную соляную кислоту. Соль начнет кристаллизоваться, при этом в растворе будут проскальзывать искры.
Наиболее красиво, если опыт ставить в темноте! Разноцветный хром! Окраска солей хрома может легко переходить из фиолетовой в зелёную и наоборот. При кипячении фиолетовый раствор этой соли становится зелёным.
При выпаривании зелёного раствора образуется зелёный порошок того же состава, что и исходная соль. Как объяснить наблюдаемое явление?

Это редкий в неорганической химии пример изомерии — существования веществ, имеющих одинаковый состав, но разные строение и свойства. В кислой среде бихроматы являются сильными окислителями. Тёмно-красный раствор, получаемый при добавлении концентрированной серной кислоты к насыщенному водному раствору дихромата калия, называется «хромпик».
В лабораториях он служит для мытья и обезжиривания химической посуды.

Посуду осторожно ополаскивают хромпиком, который не выливают в раковину, а используют многократно. Особенно сильный окислитель — оксид хрома VI СrО 3. С его помощью можно зажечь спиртовку без спичек: достаточно прикоснуться к смоченному спиртом фитилю палочкой с несколькими кристалликами этого вещества.
Он обладает ферромагнитными свойствами и используется в магнитных лентах некоторых типов аудиокассет. В организме взрослого человека содержится всего около б мг хрома. Многие соединения этого элемента особенно хроматы и дихроматы токсичны, а некоторые из них являются канцерогенами, то есть способны вызывать рак.
Данный тип химической реакции относится к окислительно-восстановительным реакциям. Итак, в одну колбу наливают раствор хлорида железа III. Затем добавляем к ней несколько капель раствора иодида калия. Наблюдаем изменение окраски раствора. Жидкость приобретёт красно-бурый цвет. В растворе будут протекать следующие химические реакции:. Ещё один химический опыт с соединениями железа. В одну колбу наливаем раствор сульфата железа II. Туда же добавляют 3—5 капель раствора тиоцианата аммония.
Замечаем, что нет никаких признаков химических реакций. Конечно, катионы железа II не образуют с тиоцианат-ионами окрашенных комплексов. Теперь в эту колбу добавляем бромную воду. А вот теперь ионы железа "выдали себя" и окрасили раствор в кроваво-красный цвет.
Вот, что происходило в колбе:. Концентрированная серная кислота обезвоживает сахар. Сахар - это сложное органическое вещество, формула которого C 12 H 22 O Вот, как это происходит.
Сахарную пудру помещают в высокий стеклянный стакан, чуть смачивают водой. Затем к влажному сахару приливают немного концентрированной серной кислоты. Палочку так и оставляют в середине стакана со смесью. Через 1 - 2 минуты сахар начинает чернеть, вспучиваться и в виде объёмной, рыхлой массы чёрного цвета подниматься, забирая с собой стеклянную палочку. Cмесь в стакане сильно разогревается и немного дымиться. При этой химической реакции серная кислота не только отбирает у сахара воду, но и частично превращает его в уголь.
Выделяющаяся вода при такой химической реакции в основном поглощается серной кислотой серная кислота "жадно" поглощает воду с образованием гидратов, - отсюда сильное выделение тепла. А углекислый газ CO 2 , который получается при окислении сахара, и сернистый газ SO 2 поднимают обугливающуюся смесь вверх.
Если реакция происходит при постоянном давлении , то часть выделившейся энергии может расходоваться на работу против сил давления за счет изменения объёма продуктов реакции, и, соответственно, тепловой эффект экзотермической реакции будет меньше.

Для реакций не сопровождающихся выделением или поглощением газов, или если число молей газа до и после реакции не изменяется, то изменение энергии и изменение энтальпии практически равны. При сгорании водорода , например:. К экзотермическим относятся реакции: горения , окисления , соединения металлов с другими элементами, радиоактивный распад и ядерный синтез лёгких элементов и т. Материал из Википедии — свободной энциклопедии.
Изменение энтальпии в ходе экзотермической реакции.
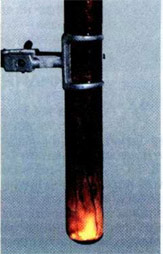
Примеры [ править править код ] Горение топлива в кислороде воздуха. Горение пороха.