Энергетические уровни фосфора, Строение атома фосфора
Индивидуальные занятия с удобным расписанием и персональным подходом. А чтобы избавиться от них и забыть, как страшный сон — он их отдаёт. Протон, нейтрон, электрон.
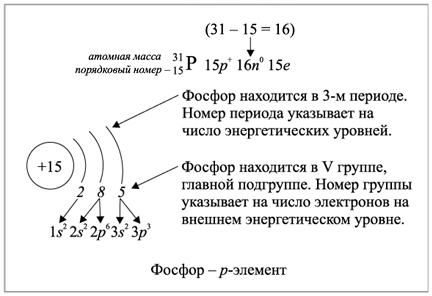
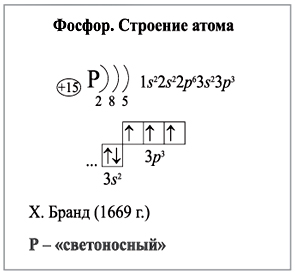
Рассмотрели схему строения атома фосфора. Формула атома — 1s 2 2s 2 2p 6 3s 2 3p 3. Элемент может переходить в возбуждённое состояние с валентностью V. Известно несколько модификаций фосфора — белый, жёлтый, красный, чёрный. Самый активный — белый фосфор — способен самовоспламеняться в присутствии кислорода. Элемент реагирует со многими металлами и неметаллами, а также с кислотами, основаниями и водой.

Строение атома фосфора. Средняя оценка: 3. Что мы узнали? Начать тест. Обозначение — P. Порядковый номер — Относительная атомная масса — 30, а.
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:. Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n главное квантовое , l орбитальное , m l магнитное и s спиновое :. Так как на третьем уровне есть вакантные орбитали 3 d -подуровня, то для атома фосфора характерно наличие возбужденного состояния:.
Тогда число нейтронов в ядре атома титана определим по формуле:.

Средняя относительная атомная масса элемента определяется суммой масс его изотопов с учетом их количества. Составим уравнение:. По условию задачи в ядре атома первого изотопа было 10 нейтронов. Значит, ядро атома второго изотопа содержит на два нейтрона больше, чем ядро первого изотопа. Для каждой реакции составьте электронный баланс, укажите окислитель и восстановитель.
В одном цилиндре находится газ азот, в другом - кислород, а в третьем - углекислый газ. Как различить эти газы?
В некоторых горючих газах содержится в виде примеси свободный азот. Может ли при сгорании таких газов в обыкновенных газовых плитах образоваться оксид азота II. Search this site. Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот: свойства и применение. Общая характеристика химических элементов подгруппы азота Подгруппа азота пниктогены — V группа, главная подгруппа «А» - азот, фосфор, мышьяк, сурьма, висмут. Свойства элементов V-A подгруппы Строение атомов химических элементов.
Возможные степени окисления N Из-за наличия трёх неспаренных электронов азот очень активен, находится только в виде соединений. Азот — простое вещество, строение молекулы, физические свойства Азот от греч. Вывод: 1. Малая реакционная способность при обычной температуре 2. Получение N 2 В промышленности азот получают из воздуха.
Report abuse. Page details. Page updated. Google Sites. This site uses cookies from Google to deliver its services and to analyze traffic. Information about your use of this site is shared with Google. By clicking "accept", you agree to its use of cookies. Cookie Policy.